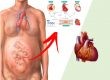
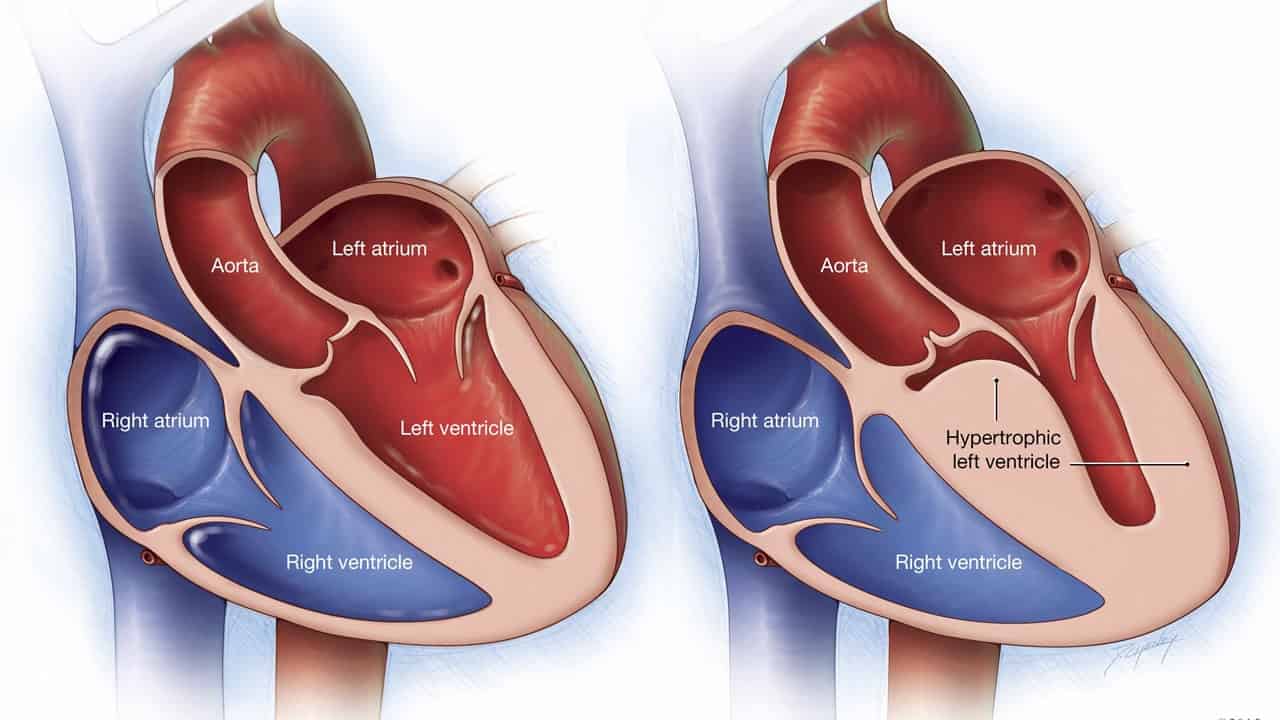
 Atualmente, sabe-se que a cardiomiopatia hipertrófica (CMH) é uma doença primária do músculo cardíaco que apresenta como característica principal a hipertrofia miocárdica que ocorre na ausência de doenças cardíacas ou sistêmicas que justifiquem o desenvolvimento dessa alteração muscular. A hipertrofia geralmente é assimétrica, o que causa redução da cavidade ventricular esquerda e disfunção diastólica, enquanto a função sistólica é normal ou hiperdinâmica. Em menos de 10% dos casos, desenvolvem-se dilatação ventricular e comprometimento da função sistólica como fase final da doença.
Atualmente, sabe-se que a cardiomiopatia hipertrófica (CMH) é uma doença primária do músculo cardíaco que apresenta como característica principal a hipertrofia miocárdica que ocorre na ausência de doenças cardíacas ou sistêmicas que justifiquem o desenvolvimento dessa alteração muscular. A hipertrofia geralmente é assimétrica, o que causa redução da cavidade ventricular esquerda e disfunção diastólica, enquanto a função sistólica é normal ou hiperdinâmica. Em menos de 10% dos casos, desenvolvem-se dilatação ventricular e comprometimento da função sistólica como fase final da doença.
A prevalência é estimada em 0,2% (1:500) da população geral e em 0,5% nos portadores de cardiopatias.
A história natural da doença, de uma forma geral, é benigna com baixa mortalidade anual < 1 %, porém a principal complicação é a morte súbita cardíaca (MSC), sendo a principal causa desses eventos entre jovens e atletas.
É a mais prevalente das cardiopatias de origem genética, com transmissão autossômica dominante, mais de 1.000 mutações em 20 genes diferentes já foram isoladas como sendo responsáveis pela doença: genes dos miofilamentos dos sarcômeros, do disco Z e do transporte de cálcio. Entretanto, os genes mais frequentemente relacionados à CMH são os da cadeia pesada da miosina, proteína C cardíaca ligada à miosina e troponina T cardíaca.
O diagnóstico diferencial deve ser feito com doença de Fabry, amiloidose cardíaca, coração de atleta, síndrome de Leopard, estenose valvar aórtica e hipertensão arterial sistêmica não controlada.
FISIOPATOLOGIA
As principais alterações fisiopatológicas encontradas na CMH são descritas a seguir:
Alteração da função diastólica
Disfunção diastólica é encontrada na maioria dos pacientes com CMH e independe da extensão e da espessura da hipertrofia.
Obstrução na via de saída de ventrículo esquerdo (VSVE)
A presença do gradiente pressórico na VSVE, ocasionando obstrução dinâmica, é motivo de estudos desde as descrições iniciais da CMH. A movimentação anterior da cúspide da valva mitral (MAS), no início da sístole ventricular, em direção ao septo espessado, seria responsável pela ocorrência desse fenômeno.
Isquemia miocárdica
A presença de um desbalanço entre a oferta e o consumo de oxigênio leva à isquêmia miocárdica, causada por:
- Aumento excessivo da massa muscular, com consequente aumento da demanda de oxigênio pelo miocárdio.
- Estrutura microvascular coronária insuficiente em relação ao aumento da massa ventricular.
- Elevação das pressões diastólicas ventriculares e compressão microvascular, diminuindo o fluxo sanguíneo principalmente na região subendocárdica.
- Espessamento das paredes das artérias coronárias com diminuição do lúmen arteriolar.
- Presença de pontes miocárdicas.
QUADRO CLINICO
A maioria dos pacientes com CMH é assintomática ou oligoassintomática e tem seu diagnóstico suspeitado pela detecção de sopros cardíacos, alterações em eletrocardiograma ou durante a investigação de famílias acometidas.
Em um acompanhamento de 8 anos com 227 pacientes, em que 90% eram assintomáticos no início da randomização, apenas 25% dos pacientes evoluíram para sintomas incapacitantes ou morreram e 69% dos pacientes mantiveram-se assintomáticos ou apresentavam apenas sintomas leves. Os sintomas mais comuns são: dispneia, precordialgia, palpitações, síncope e pré-síncope. A intensidade de cada sintoma depende da presença e da combinação dos componentes fisiopatológicos.
Exame físico
Em pacientes assintomáticos e sem obstrução da VSVE, o exame físico costuma ser normal. O ictus é amplo, forte e desviado para a esquerda e pode-se palpar frêmito sistólico no nível da ponta ou na
borda esternal baixa. O pulso venoso jugular pode apresentar onda A elevada pela contração atrial acentuada resultante da diminuição da complacência do ventrículo e o pulso carotídeo aspecto bisferiens pode ser encontrado em pacientes com obstrução na VSVE. Os achados encontrados na ausculta cardíaca são: presença de B4 (contração atrial), desdobramento paradoxal da B2 (atraso do fechamento valvar aórtico nas formas obstrutivas) e sopro cardíaco sistólico, rude, “crescendo-descrescendo principalmente ao longo da borda esternal esquerda baixa, resultante do fluxo turbulento na via de saída estreitada do VE. Esse sopro é semelhante ao da estenose aórtica, porém além de não irradiar para o pescoço, a realização de algumas manobras propedêuticas contribui no diagnóstico diferencial. Um segundo sopro holossistólico suave, no ápice e que irradia para a axila pode ser audível quando a regurgitação mitral está presente.
DIAGNOSTICO
Eletrocardiograma: em razão do seu baixo custo e do fácil acesso, pode ser realizado como exame de primeira escolha na triagem dos pacientes. As alterações aparecem precocemente, antes mesmo da adolescência, fase em que o ecocardiograma costuma ser normal. Apesar de possuir boa sensibilidade (alterado em mais de 90% dos pacientes), é pouco específico e não há padrão característico da doença. Sobrecarga ventricular esquerda, ondas Q profundas em parede inferior e alterações do segmento ST são comuns.
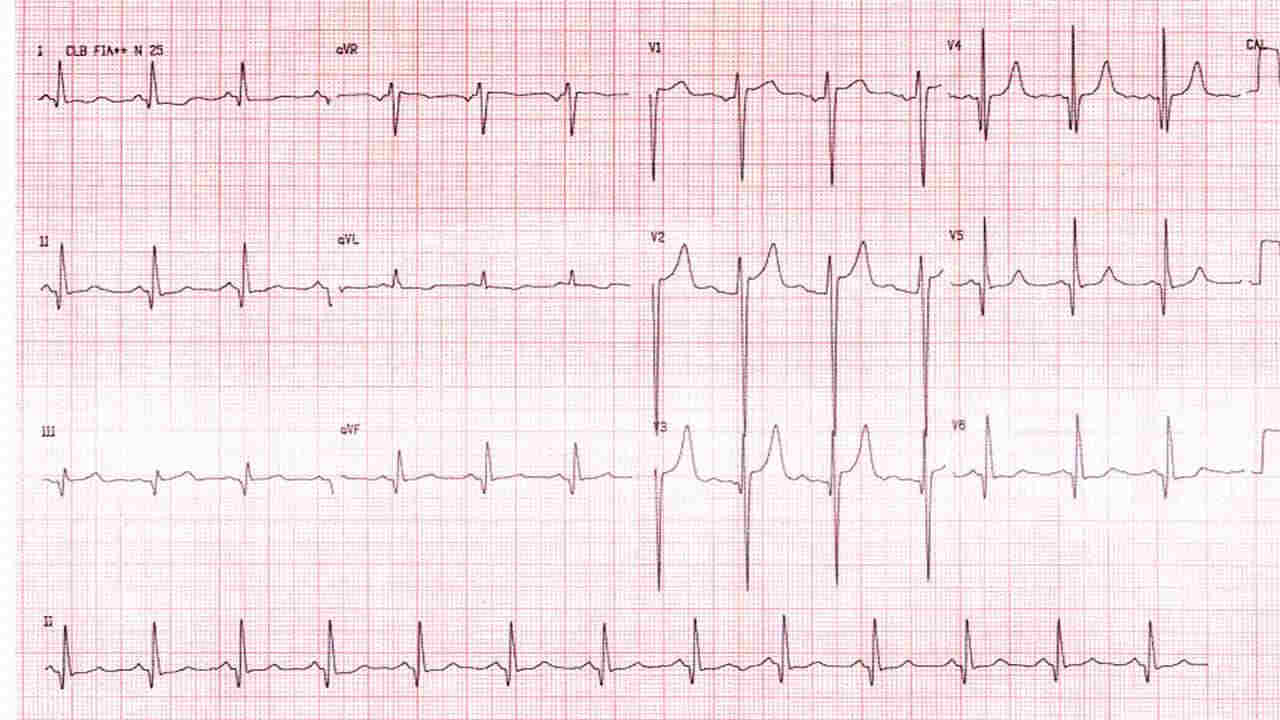
O aparecimento de ondas T negativas gigantes e simétricas em derivações precordiais é típico da forma apical da CMH. Fibrilação atrial é observada em 5 a 8% dos pacientes (indicação de anticoagulação independente do escore de CHA2DS2VASC) e síndrome de Wolff-Parkinson-White em 1 a 2%.
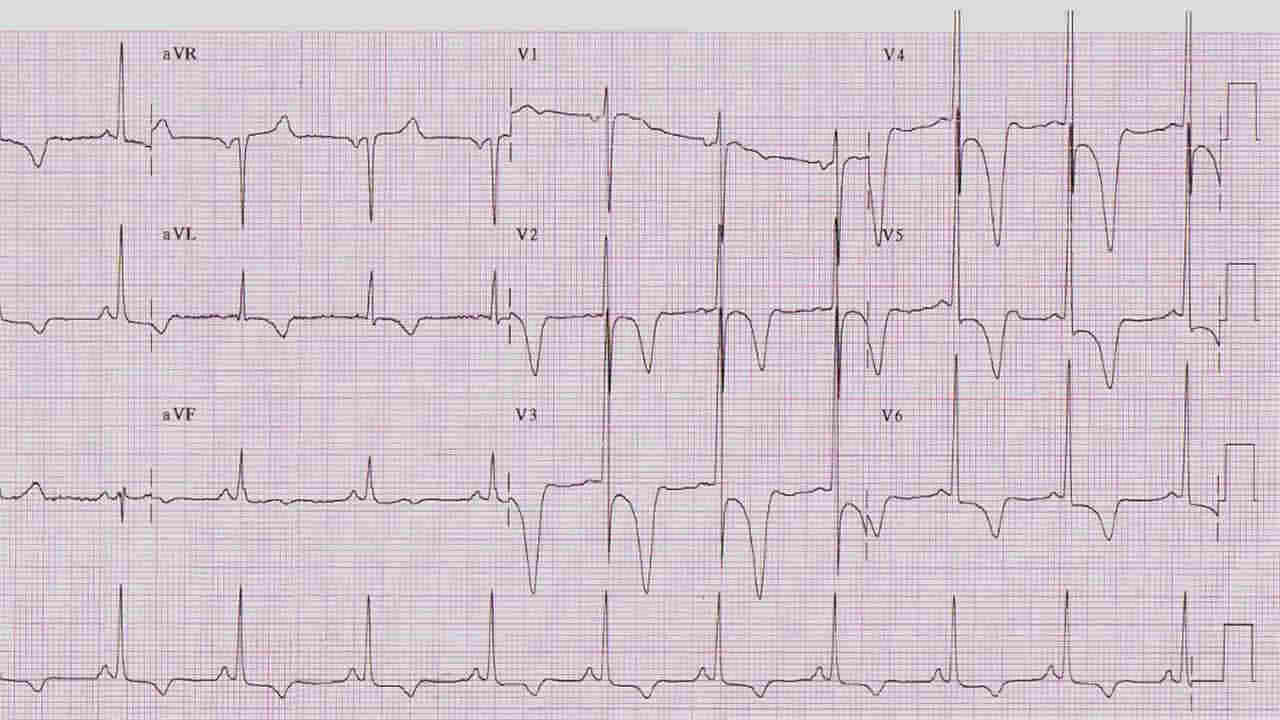
Ecodopplercardiograma: constitui o principal método de diagnóstico da CMH, permitindo estabelecer o diagnóstico, a localização e o grau de hipertrofia. Determina a presença e o grau de obstrução, assim como é importante no acompanhamento evolutivo da doença. O diagnóstico é confirmado pela presença de espessura do septo ou parede livre ~ 15 mm ou ~ 13 mm em pacientes com histórico familiar de primeiro grau com a doença, sendo que esta hipertrofia não é explicada pela presença de outras doenças cardíaca ou sistêmica. Outros achados relevantes encontrados na ecocardiografia
são:
- Quanto à presença do gradiente na VSVE:
– Gradiente VSVE ≤ 30 mmHg em repouso – forma não obstrutiva.
– Gradiente VSVE > 30 mmHg em repouso – forma obstrutiva.
– Gradiente VSVE ≤ 30 mmHg em repouso > 30 mmHg no esforço – forma obstrutiva latente.
- Forma assimétrica: relação entre espessura do septo e da parede posterior do VE > 1,5.
- Regurgitação mitral e MAS.
- Cavidade ventricular normal ou diminuída.
- Aumento do átrio esquerdo.
- Disfunção diastólica com padrão de onda E < A.
A realização do ecocardiograma possui recomendação classe I nas seguintes situações:
- avaliação inicial.
- piora dos sintomas ou evento cardiovascular.
- triagem de familiares de primeiro grau nos quais não foi encontrada a mutação genética no caso índice.
- a partir de 12 anos e periódico a cada 12 a 18 meses como triagem familiar.
- realização de ecocardiograma transesofágico no intraoperatório de cirurgia de miectomia.
Holter 24 horas: exame complementar obrigatório que deve ser solicitado rotineiramente para avaliar a presença de taquicardia ventricular sustentada (TVS) e não sustentada (TVNS) e sempre que ocorrer aparecimento de palpitações ou pré-síncope. Na estratificação da MSC, pode ser repetido a cada 1 a 2 anos.
Teste de esforço: deve ser realizado de preferência em ambiente hospitalar e com acompanhamento médico durante todo o esforço por causa do risco de complicações potencialmente fatais. Pode ser solicitado para avaliação da capacidade funcional e resposta terapêutica, se possível, associado a medidas de consumo de oxigênio (ergoespirométrico); e para avaliação das formas obstrutivas latentes associado ao ecocardiograma. O teste ergométrico é útil na estratificação de risco para MSC, já a resposta anormal da pressão arterial (elevação ≤ 20 mmHg ou queda > 20 mmHg da pressão arterial sistólica durante o esforço) demonstrou ser um fator de risco para MSC.
Ressonância magnética: nos últimos anos, a ressonância magnética cardiovascular (RMC) emergiu como um instrumento bastante preciso no diagnóstico de CMH, especialmente nos casos em que as áreas de hipertrofia se tornam tecnicamente difíceis de serem avaliadas pela ecocardiografia convencional. A grande precisão da RMC na análise anatomofuncional dos ventrículos esquerdo e direito e na quantificação do volume e da massa ventricular aumentou a sensibilidade e a especificidade do diagnóstico de CMH, permitindo a identificação precisa de diversas formas de hipertrofia. Dever ser sempre solicitada quando o ecocardiograma é inconclusivo para diagnóstico e para avaliações adicionais da distribuição e da localização da hipertrofia, e da anatomia da valva mitral e do músculo papilar quando indicado tratamento invasivo. É útil no diagnóstico diferencial de outras cardiopatias, como hipertrofia benigna do atleta, amiloidose e doença de Fabry. Na estratificação de risco para MSC, pode ser solicitada para avaliar a presença de fibrose miocárdica com infusão de gadolíneo, que está relacionada diretamente com a ocorrência de arritmias ventriculares e progressão para fases finais com a dilatação do VE.
Diagnóstico genético-molecular: a análise do DNA constitui o método definitivo para a identificação da CMH, possibilitando a realização do diagnóstico na fase pré-clínica da doença e mesmo antes de ocorrerem alterações estruturais cardíacas. O substrato molecular heterogêneo, representado por centenas de mutações em múltiplos genes, confere complexidade ao diagnóstico genético e pode limitar sua aplicação clínica de rotina. Em aproximadamente 60 a 70% dos casos com antecedente familiar de CMH, é identificada a mutação nos pacientes; porém, quando não se identifica este histórico, apenas cerca de 10 a 50% têm a mutação encontrada. O teste genético, sempre que possível, deve ser realizado em todos pacientes com CMH e uma vez identificada a mutação específica no caso índice, deve ser realizado como triagem em todos os parentes de primeiro grau. A avaliação da genética na estratificação de risco de MSC, com as evidências atuais, ainda é incerta.
AVALIAÇÃO DO RISCO E PREVENÇÃO DE MORTE SUBITA CARDIACA (MSC)
A MSC é a principal e mais temida complicação da CMH por causa do potencial de ocorrência inesperada e repentina, sobretudo pela possibilidade de se consolidar em primeira manifestação da doença. A fibrilação ventricular (FV), precedida ou não por episódio de taquicardia ventricular (TV), é o principal fator responsável por esses eventos. Algumas variáveis clínicas e fatores de risco foram identificados como marcadores de risco para MSC nesses pacientes.
- Pacientes que sobreviveram a parada cardíaca com FV documentada ou que tiveram episódio de TVs.
- História familiar de morte súbita em parentes de primeiro grau com idade inferior a 50 anos.
- Síncope recente inexplicada e de repetição.
- Espessura septal do miocárdio ≥ 30 mm.
- TVNS com frequência > 120 bpm no Holter.
- Queda da pressão sistólica (PAS) >20 mmHg ou aumento < 20 mmHg ao esforço.
Em pacientes que não apresentam fator de risco, a incidência de MSC é < 1 % ao ano, e em pacientes com um ou mais fatores de risco a incidência é entre 1 ,4 e 5,0% ao ano. Atualmente, a única opção de tratamento com evidências para prevenção dessa complicação é a indicação do cardiodesfibrilador implantável, entretanto identificar os indivíduos que se beneficiam deste dispositivo ainda é um dos maiores desafios da prática clínica. As orientações das diretrizes Brasileiras de Dispositivos Cardíacos Eletrônicos diferem das diretrizes americanas publicadas em 2011.
| Fatores de risco maior | Fatores de risco menor |
| Prevenção secundária
• Parada cardíaca (TV ou FV) |
• Fibrilação atrial
• Obstrução de via de saída • Mutação de alto risco |
| Prevenção primária
• TVS espontânea • História familiar de MS (< 50 anos) • Síncope inexplicada • Espessura de parede > 30 mm • TVNS |
FV; fibrilação ventricu lar; MS: morte súbita; TV: taquicardia ventricular; TVNS: taquicardia ventricular não sustentada; TVS: taquicardia ventricular sustentada.
Recomendações das Diretrizes Brasileiras de Dispositivos Cardíacos Eletrônicos Implantáveis para implante de cardiodesfibrilador implantável em pacientes com cardiomiopatia hipertrófica (2007):
| Classe I |
| Pacientes com CMH que tenham apresentado TV/FV sustentada, de causa não reversível e expectativa de vida de pelo menos 1 ano. |
| Classe IIa |
| Pacientes com CMH que apresentem 1 ou mais fatores de risco maiores para MSC e expectativa de vida de pelo menos 1 ano. |
CMH: cardiomiopatia hipertrófica; FV: fibrilação ventricu lar; MSC: morte súbita cardíaca; NE: nível de evidência; TV: taquicardia ventricular.
Recomendações das Diretriz Europeia de Cardiomiopatia Hipertrófica (2014):
A Diretriz Europeia de CMP hipertrófica recomenda a utilização de um escore de risco que leva em consideração a idade (inversamente proporcional ao risco), espessura da parede ventricular, diâmetro do átrio esquerdo, gradiente da via de saída do VE, história familiar de MSC, TVNS e síncope. Esse escore define o risco de MSC em 5 anos e deve ser calculado eletronicamente utilizando aplicativos ou através de calculadora de escore na web (https://qxmd.com/calculate/calculator_303/hcm-risk-scd).
| Classe I |
| Pacientes com CMH que tenham apresentado TV/FV sustentada, de causa não reversível e expectativa de vida de pelo menos 1 ano. |
| Classe IIa |
| Pacientes com CMH com escore de risco de MSC em 5 anos ≥ 6% e expectativa de vida > 1 ano. |
| Classe IIb |
| Pacientes com CMH com escore de risco de MSC em 5 anos ≥ 4% e < 6% e expectativa de vida > 1 ano. |
| Classe III (contraindicado) |
| Pacientes com CMH com escore de risco de MSC em 5 anos < 4%. |
TRATAMENTO
O tratamento da CMH está reservado para pacientes sintomáticos e pode ser dividido em tratamento farmacológico e intervenções invasivas. A maioria dos pacientes necessita apenas de terapia farmacológica, sendo que as intervenções invasivas são necessárias em apenas 5 a 10% dos pacientes e naqueles que possuem gradiente pressórico na VSVE. Os pacientes assintomáticos apresentam evolução clínica benigna e não devem receber nenhum tratamento.
Tratamento farmacológico
Betabloqueadores
São as principais drogas no tratamento farmacológico da CMH. Aliviam os sintomas em 2/3 dos pacientes e reduzem obstrução da VSVE durante o esforço físico, sendo, portanto, a droga de escolha para esses pacientes. A dose deve ser aumentada gradualmente até que se consiga alívio dos sintomas ou uma frequência cardíaca em repouso entre 50 e 60 bpm.
Bloqueadores dos canais de cálcio
Constituem uma alternativa ao bloqueio beta-adrenérgico. Em pacientes que respondem inadequadamente à monoterapia, pode ser tentada a associação das duas drogas. O verapamil é o antagonista do cálcio que tem sido mais amplamente utilizado e os efeitos mais importantes devem-se a melhora do enchimento diastólico, redução do assincronismo do relaxamento, melhora regional do fluxo coronariano e redução da contratilidade miocárdica. Na presença de contraindicação ou intolerância ao verapamil, o diltiazem pode ser usado.
Disopiramida
É um agente antiarrítmico que altera a cinética do cálcio. Não é produzido no Brasil, e seu uso tem demonstrado melhora nos sintomas e na redução do gradiente pressórico em repouso nos pacientes portadores de CMH e associado às demais drogas.
Tratamento invasivo
Indicado apenas para pacientes sintomáticos, classe III e IV (New York Heart Association – NYHA), refratários à medicação otimizada e que possuem gradiente na VSVE.
Cardiomiectomia transvalvar aórtica
Considerada o padrão-ouro de tratamento, desde que realizada em centros cirúrgicos com experiência nesta patologia, uma vez que os resultados cirúrgicos em longo prazo são bons e mostram melhora dos sintomas e da capacidade funcional em mais de 95% dos pacientes. Foi o primeiro tipo de tratamento proposto para essa doença e consiste na retirada de uma porção de músculo do septo ventricular, aliviando a VSVE. Possui a vantagem de que pode ser combinada com outros procedimentos cirúrgicos (revascularização, troca valvar).
Tratamento percutâneo (alcoolização septal)
Procedimento que consiste na oclusão de um ramo septal principal da artéria descendente anterior pela injeção de álcool absoluto por meio da técnica de cateterismo coronariano percutâneo, causando infarto da região septal. Os resultados demonstram redução da espessura do septo interventricular basal, aumento da área da VSVE e diminuição do gradiente da VSVE. Ainda é uma alternativa terapêutica em pacientes com idade avançada e/ou com comorbidades, alto risco cirúrgico, e que não desejam ser submetidos ao procedimento cirúrgico.
Estimulação cardíaca artificial
A presença do eletrodo na ponta do ventrículo direito determina uma mudança de ativação contrátil do miocárdio, ocorrendo a movimentação paradoxal do septo interventricular, aumentando a câmara ventricular e reduzindo o gradiente da VSVE. Estudos randomizados prévios demonstraram um importante efeito placebo do procedimento, ficando como indicação reservada apenas aos pacientes não candidatos à miectomia septal cirúrgica ou ao tratamento percutâneo de redução septal.
Transplante cardíaco
Torna-se a única opção terapêutica para os pacientes sintomáticos e refratários ao tratamento medicamentoso otimizado, na ausência da obstrução em VSVE como uma doença restritiva grave e com função sistólica preservada, ou também no estágio final da doença com dilatação ventricular e disfunção sistólica.
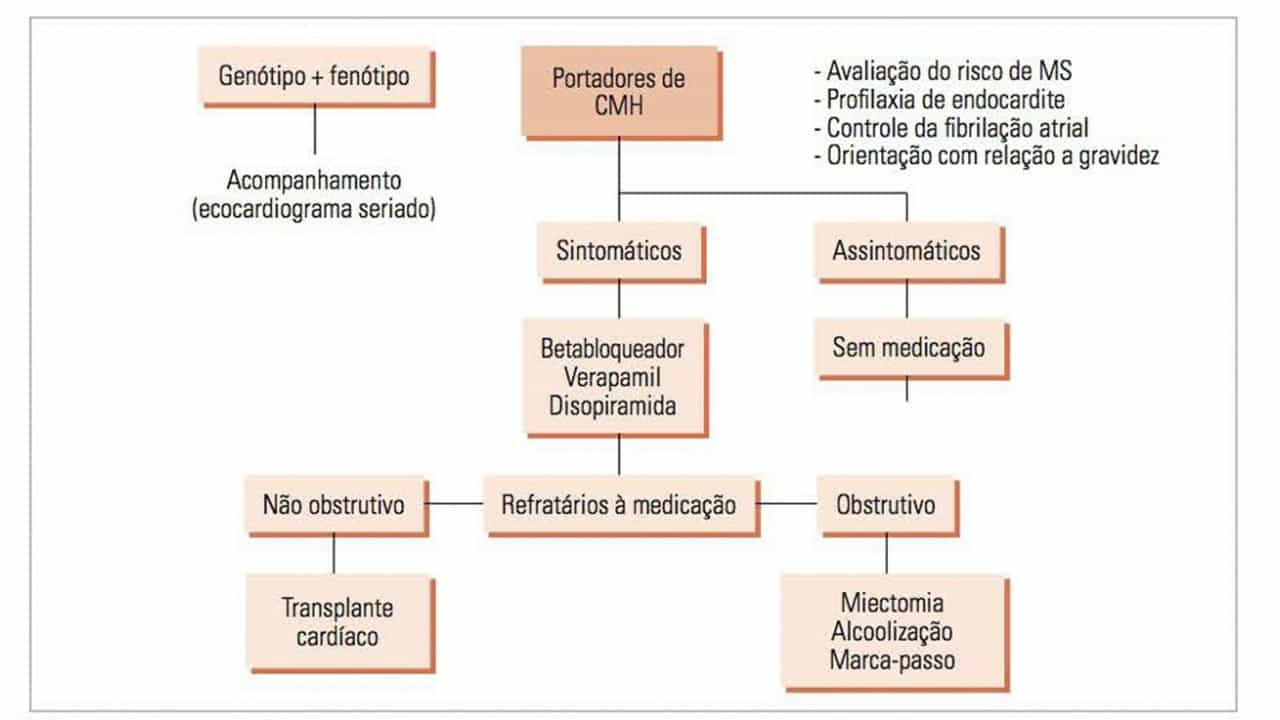
ORIENTAÇÕES GERAIS
A triagem familiar com eletrocardiograma, ou idealmente ecocardiograma, deve ser realizada a cada 12 a 18 meses em todos os parentes de primeiro grau com CMH com idade de 12 a 21 anos e após esta idade, a cada 5 anos. Para crianças (idade< 12 anos) que cursam com sintomas ou que desejam participar de competições esportivas de alta intensidade também é realizada a triagem. A endocardite infecciosa pode ocorrer em 5% dos pacientes portadores da forma obstrutiva da doença, porém as novas recomendações da AHA/ ACC para prevenção dessa patologia, atualizadas em 2008, não indicam a profilaxia para esse grupo de doentes. Fibrilação atrial tem sido documentada em 15 a 25% dos doentes e sua ocorrência está associada à piora da dispneia, assim deve-se sempre tentar a manutenção do ritmo sinusal. O registro dessa arritmia é indicativo de anticoagulação oral independente dos fatores de risco. A gravidez é considerada de alto risco em pacientes com CMH obstrutiva com gradiente de VSVE > 50 mmHg ou sintomas refratários ao tratamento medicamentoso. Em pacientes assintomáticas, geralmente a gestação é bem tolerada, com risco pouco elevado de prematuridade e mortalidade materna, porém o alto potencial de transmissão genética da doença indica aconselhamento genético antes de planejar a gravidez. Atividades físicas competitivas de moderada e alta intensidade devem ser contraindicadas para todos os indivíduos portadores de CMH em razão do risco de MSC. As atividades de baixa intensidade, com consumo máximo de 02 < 40%, podem ser liberadas (boliche, golfe, bilhar, tiro ao alvo). Pacientes com genótipo positivo e fenótipo negativo não possuem restrição para a prática de atividades físicas.